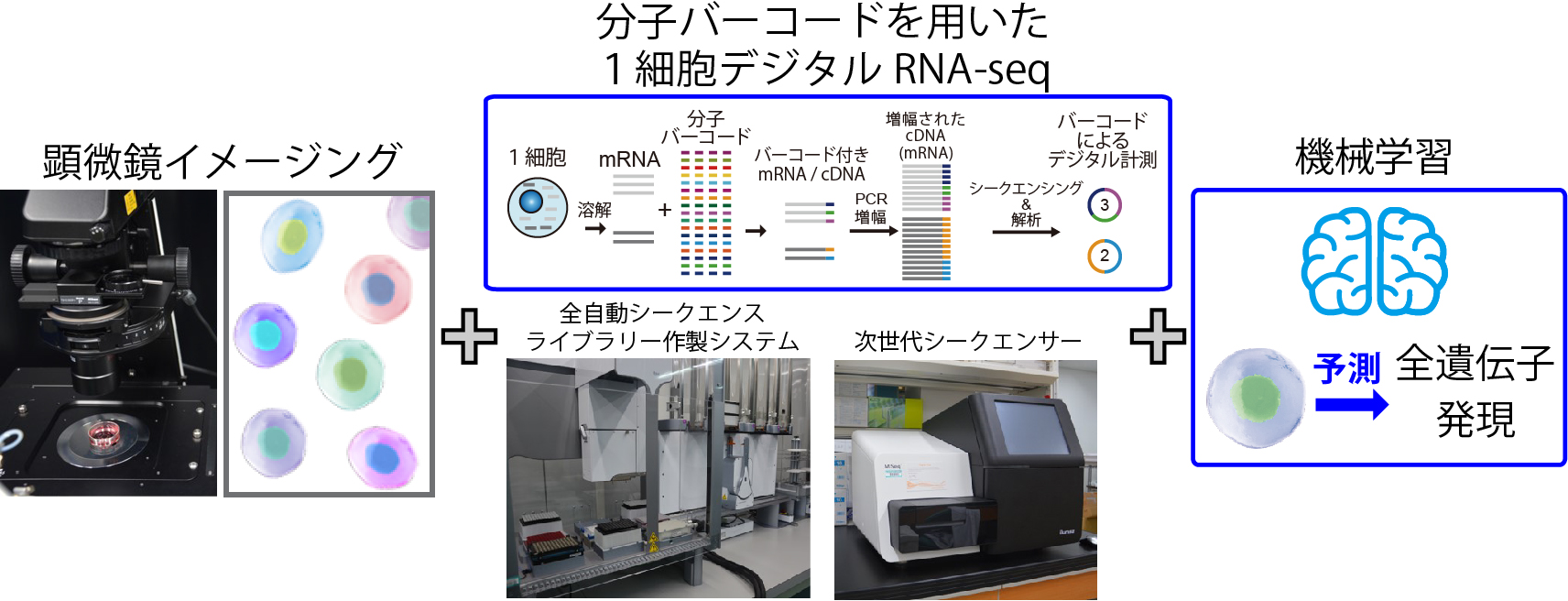
研究テーマ一覧
細胞ライブイメージングと1細胞RNAシークエンシングの融合
概要
関連研究室
細胞内微細構造の3次元超解像ライブイメージング
概要
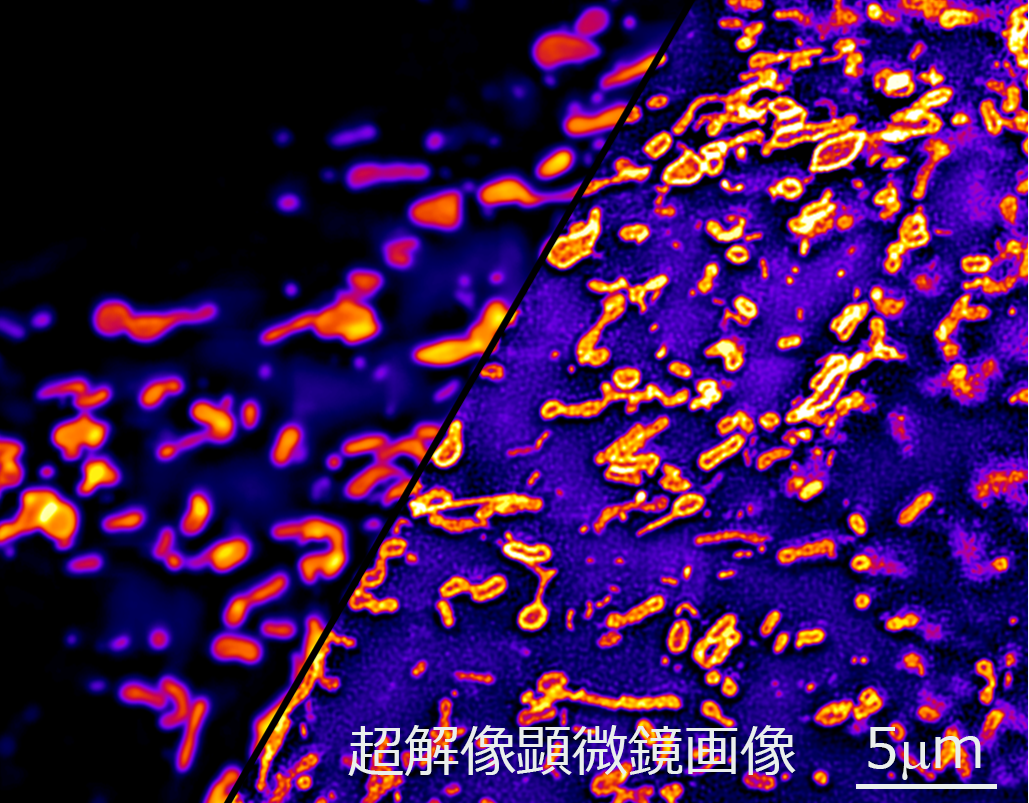
独自に開発した「高速超解像顕微鏡」を用いて、世界最高のシャッター速度で、生きた細胞内の微細構造を観察します。ミトコンドリアなど細胞内小器官の形態と動態、核内微細構造の詳細な観察により、細胞の状態を活きたまま非侵襲でDECODEします。
超解像顕微鏡で撮影したミトコンドリア外膜
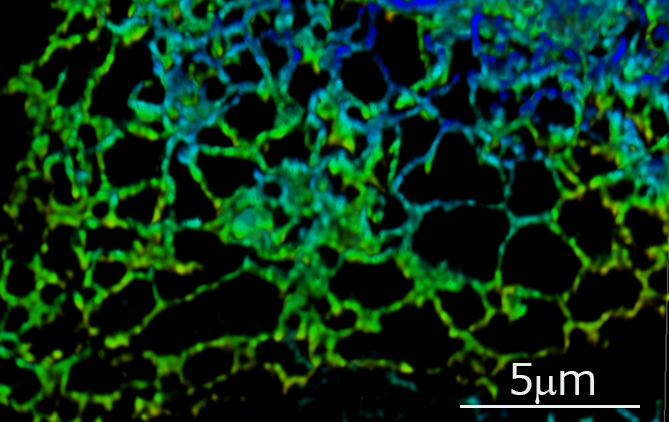
小胞体の3次元超解像ライブイメージング画像
関連研究室
ラマン散乱スペクトル―RNA シーケンスデータ対の収集
概要
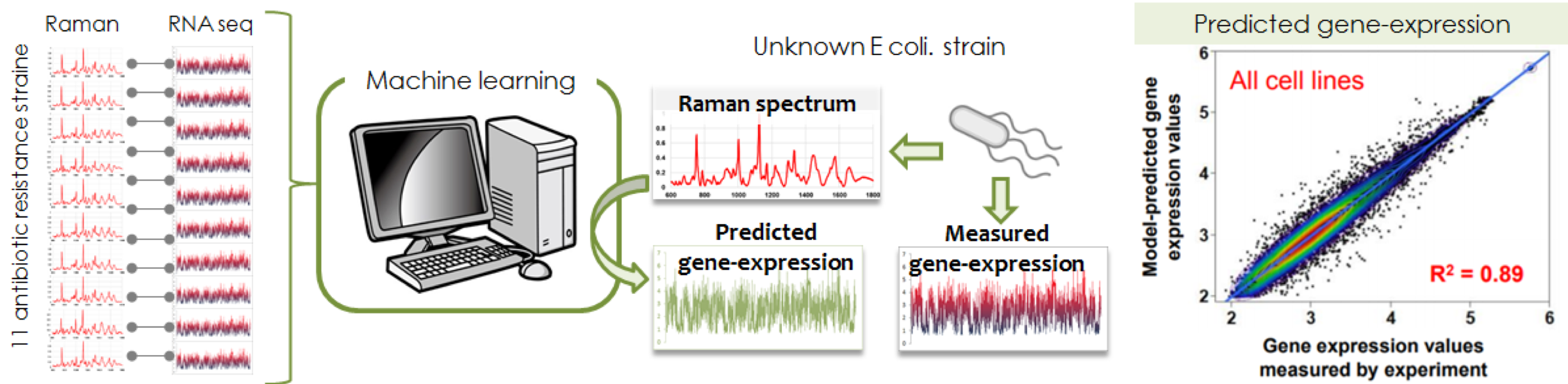
私たちは、細胞から発せられるラマン散乱光から遺伝子発現を予測する技術を確立し、この『散乱光から細胞内部を予測/推定する』コンセプトを実証することを目指しています。散乱光のひとつであるラマン散乱光のスペクトル形状は、物質内部の全ての分子振動モード(CC、SH、ベンゼン環等)により決定されます。細胞は大小種類を問わず様々な分子種から構成されているため、細胞から発せられるラマン散乱光のスペクトルは、分解分析することは出来ないほどに複雑になります。しかし、どれだけ複雑であっても、細胞内で遺伝子発現が変化すれば、構成分子の種類や比率も変化し、それに伴いラマン散乱スペクトルも変化します。つまり、計測されるラマン散乱スペクトルは「細胞の機能/状態」を介して遺伝子発現パターンと間接的であるが確実に相関関係があるはずです。複雑に修飾された散乱光(非侵襲で計測できる
ラマン散乱光)から、観察試料の内部状態(侵襲的にしか計測できない遺伝子発現)を予測/推定できる可能性があるのです。
上述のコンセプトを実証するため、10種類の薬剤耐性菌のラマン散乱スペクトルとRNAシーケンスデータのペアを収集し、これら二つの異なるデータペアをつなぐための機械学習モデルを構築しました。この機械学習モデルにより80~90%の精度で、ラマン散乱スペクトルから薬剤耐性大腸菌の遺伝子発現パターンを推測することに成功しています。さらに私たちは、哺乳類細胞においても同じコンセプトが成立することを実証するために、疾患由来人工多能性幹細胞(iPS細胞)を用いた同実験を行うと共に、単細胞におけるラマン散乱スペクトル―RNA
シーケンスデータ対の自動収集を可能とする顕微鏡システムの構築を行っています。
クリックすると拡大します
生きた卵母細胞・受精卵における染色体同定技術の開発
概要
細胞には、サイズや遺伝子密度の異なる複数の染色体が存在し、細胞分裂によって均等に分配されていく。卵母細胞や受精卵では、老化に伴って特定の染色体で分配異常が起こることが知られている。これまで個々の染色体の動的な挙動を解析できるツールはなく、なぜ特定の染色体で分配異常が起こるのかは不明である。そこで、本研究では、生きたマウス卵母細胞や受精卵における個々の染色体を同定可能な解析ツールを作製し、4Dイメージングによる分配異常メカニズムの解明を行う。不活型Cas9と複数種の蛍光タンパク質によって、全ての染色体に蛍光タンパク質による“模様”を施し、その模様をもとに全20種(1-19番、X)存在する染色体を同時に同定し、その動的挙動を解析していく。
関連研究室
人工MET発生系と機械学習を組み合わせた細胞特異性の同定と解析
概要
腎臓発生の過程で、腎臓前駆細胞である腎間葉系前駆細胞は、間葉上皮転換(MET)をすることで腎胞となり最終的にネフロンという腎臓の機能を担う上皮構造へと発達する。我々はこれまでの研究で、ヒトiPS細胞から誘導した腎間葉系前駆細胞にカノニカルWnt刺激を与えることで、in
vitroでMETを起こす系を作成した。そして、この腎間葉系前駆細胞のMETは、一定であるが、とても低い確率でしか発生しない。一見均一な細胞から構成される集団内部で、低い確率でしかMETイベントが発生しないのはなぜなのか。
本研究計画では、「METイベントの人工発生系」を用いて、in
vitroにおいて腎臓前駆細胞の上皮化が一定確率で発生する原因となる細胞特異性を明らかにする。具体的には、「METイベントが発生する予定細胞」を仮定し、これを同定する。そのために、METイベントのリアルタイムモニタリングの系を構築した上で、機械学習系を用いて、METが発生する直前の細胞をprospectiveに検出し、その特徴を解析する。
本研究により、ヒト腎臓におけるネフロン数が決定される機構の解明に迫ると共に、その知見は将来的に、腎臓組織を人工的に効率的に誘導する新たな手法の開発にも応用利用できる。

クリックすると拡大します
ナノ流体チップ -マイクロからナノへ-
概要
当チームでは、高速・高解像での細胞分析が可能なマイクロデバイスの開発において世界をリードする技術・実績を有し、バイオ研究に展開してきた。BDR内においても、各チームやプロジェクトに細胞や組織の解析等のためのマイクロデバイスを作製・供与してきた。近年ではこのコンセプトを分子、すなわちナノスケールに展開し、BDRが得意とする分子の計測・計算・解析の技術と融合し、新たな研究領域を切り拓こうとしている。
ただし、ナノスケールは単に作製が困難なだけでなく、水やものを流すのも困難であり、分子とバルクの境界領域にあるため、水やその他分子の振る舞いがバルクと異なることも示唆されており、エンジニアリングだけでなくサイエンスの意味合いも強い前人未到の開拓困難な領域であるが、それゆえに世界の他の研究所等ではできず、きわめてインパクトの大きい成果が期待される。
本プロジェクトはその領域にバイオ研究プラットフォームを構築して一分子レベルでの精密な操作を可能とすることを最終的な目的とし、その前段階としてそもそも世界でも類を見ない、ナノサイズの流路の作製、流体導入、計測といった基盤技術を岡田TLとの連携のもと確立することを目標とした。
関連研究室
新規組織幹細胞とそのニッチの探索
概要
成体組織の恒常性は組織幹細胞によって支えられている。特に組織幹細胞の自己複製能と多分化能が組織の新陳代謝や損傷再生の要である。呼吸器は常に外気を取り込むことで生理機能を果たすため、外環境から侵入する細菌、ウィルス、有害物質により組織損傷を受ける可能性に晒されている。呼吸器上皮組織は、平常時は代謝は比較的ゆっくりだが、傷害を受けると急速に細胞増殖し、障害部位を修復する。このような幹細胞が障害に応答して再生能を賦活化する様式の組織再生は獲得性組織再生(facultative
regeneration)と呼ばれ、組織幹細胞の潜在的な自己増殖能、多分化能のダイナミックな変化が特徴となる。多様な障害に対応するため、呼吸器の特に上皮組織には多種の組織幹細胞が存在することが知られている。
最近の幹細胞培養技術の革新により、成体の組織幹細胞を研究室内で長期培養し、オルガノイドと呼ばれるミニ臓器を再構成することが可能になった。肺オルガノイド培養は、肺の組織幹細胞を単離し、3次元足場上で培養することでスフェア状に成長させる培養系であり、肺の幹細胞動態研究に適している。本研究計画では城口研究室とともに行う肺の組織幹細胞とオルガノイドの画像解析とscRNA-seq解析を組み合わせ、新規幹細胞の探索を行う。選ばれた新規マーカー候補はマウス肺を使ってその性質を検証する。特に新陳代謝や損傷再生時における細胞動態からin
vivoでの幹細胞性を検証する。
関連研究室
神経オルガノイド誘導過程における神経上皮形成のDECODE
概要
神経オルガノイドは多能性幹細胞由来の三次元神経組織である。オルガノイドの分化誘導過程においては自己組織化的に神経上皮が形成されるが、どのように上皮構造が形成されるのかはわかっていない。本課題では、神経上皮を蛍光識別できるノックインヒト多能性幹細胞を用いて神経オルガノイドを誘導し、その分化過程を4Dイメージングで観察することで立体組織における上皮構造がどのように形成されるのかを捉える。上皮が形成されるキーポイントにおいて遺伝子バックグラウンドを明らかにすることで、複雑な組織が形成されるメカニズムを明らかにする。
イメージデータを用いた線虫における老化状態の予測
概要
老化は生涯かけて起こる比較的ゆっくりとした過程である。老化過程に時間がかかることに加え、 遺伝や環境によって変化することから、老化過程の包括的理解にはまだ至っていない。 本研究計画では、遺伝的に均一なモデル生物である線虫C. elegansを用い、外見の変化、遺伝子発現変化、 代謝の変化、筋肉の機能変化を、生涯にわたってモニターすることで、老化過程を包括的に理解することを目指す。 さらに、機械学習を用い各パラメーターの特徴を結びつけることで、取得したデータの相互関係について理解を進めることで 外見のイメージデータから、その個体の老化の状態を予測することを目指します。
1 細胞 3D ゲノム情報を利用した遺伝子発現動態と細胞分化
概要
細胞内のゲノム DNA は、複雑に折り畳まれた 3D ゲノム構造を形成し、 細胞核内に収納されています。この 3D ゲノム構造は、 遺伝子の転写を含む様々な核内現象に重要な役割を果たしているとされていますが、 その関連性の詳細はまだ多くが解明されていません。 本課題では、オミクス技術によって得られる 3D ゲノム構造と遺伝子発現動態の両者を統合的に解析することで、 それらの関係を深く理解することを目指しています。 さらに、3D ゲノム構造と遺伝子発現情報を同時に取得する 1 細胞マルチオミクス技術の開発にも取り組みます。 本研究を通じて、3D ゲノム構造の情報を利用し、遺伝子発現情報とは異なる新たな視点から細胞状態を理解できれば、 将来的には、その情報を基に機械学習などを活用することで、細胞分化系譜を予測する技術に繋がることが期待されます。
関連研究室
単一遺伝子由来分子の活性依存的な簡易スクリーニング法の開発
概要
生体高分子の遺伝学的な機能解析や、希望の性質や機能を有する分子の獲得を目指す際、 「変異→淘汰→増幅」を試験管内で再現することで膨大な分子ライブラリから目的分子を選択できる進化分子工学技術は非常に有用である。 しかし、一般的な進化分子工学は結合親和性で分子を選別するケースが多いため、 結合親和性以外の機能に焦点を当てた分子の選別には工夫を要する。 これを汎用的に行う系として、本研究では人工細胞内で発現した分子バリアントを活性依存的に選別する簡易方法の開発を目指す。 具体的には、単一遺伝子を半透過性膜(約2~3 kDa 以下の低分子のみ透過可能な膜)で構成された小胞に内包し、 無細胞タンパク質合成系 PURE system [Shimizu Y, Nat. Biotechnol., 2001]によって目的分子を発現させたのち、 蛍光・発色・発光基質などを小胞外溶液から浸透させて分子と反応させたときの光強度を測定することで、 分子機能依存的にライブラリ(~105)から希望する高分子を選別する方法を確立する。 本研究が達成されれば、塩や金属イオンの種類や濃度、pH、などの多様な生理学的条件下における生体高分子の活性を定量的に測定して、 汎用的に目的分子の機能を解析することが可能になる。また、天然分子より高い活性を示す酵素の獲得、 あるいは新規性プローブやバイオセンサー、医薬品候補分子の開発にも貢献すると期待される。
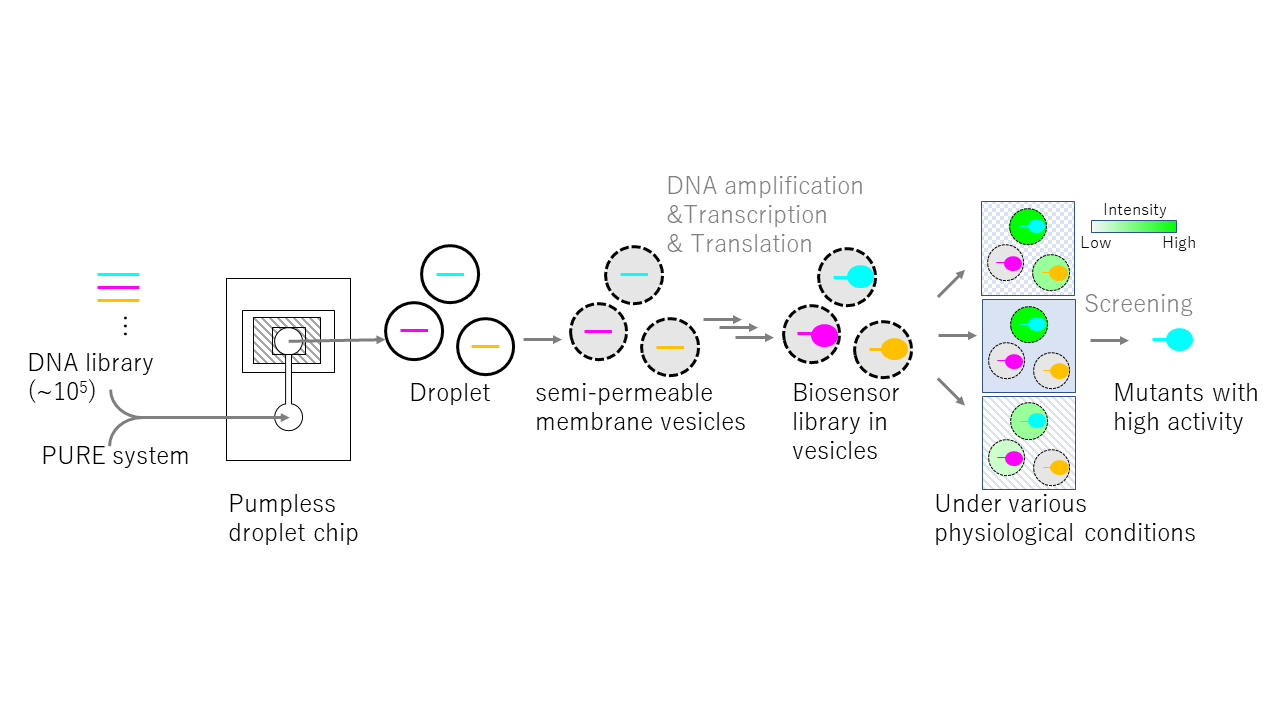
クリックすると拡大します